مواد شیمیایی معدنی و ترکیبات
به روز رسانی شده در ۱۴۰۴/۱۱/۱۰ زمان مطالعه 10 دقیقهدر گسترده ترین مفهوم، مواد شیمیایی معدنی و ترکیبات با آنچه که نیستند تعریف می شوند. آنها در طبیعت آلی نیستند، به طوری که هر چیزی فراتر از بیولوژیکی، هیدروکربنی، و سایر مواد شیمیایی مبتنی بر کربن مشابه ممکن است غیرآلی در نظر گرفته شود. از نقطه نظر عملی، مواد شیمیایی معدنی موادی با منشاء معدنی هستند که در ساختار مولکولی خود کربن ندارند و معمولاً بر اساس فراوان ترین مواد شیمیایی روی زمین هستند: اکسیژن، سیلیکون، آلومینیوم، آهن، کلسیم، سدیم، پتاسیم و منیزیم.

20 ماده شیمیایی معدنی برتر تولید شده در کانادا، چین، اروپا، هند، ژاپن و ایالات متحده (داده های 2005) عبارتند از:
سولفات آلومینیوم آمونیاک نیترات آمونیوم سولفات آمونیوم کربن سیاه کلر اسید هیدروکلریک هیدروژن پراکسید هیدروژن اسید نیتریک | نیتروژن اکسیژن اسید فسفریک کربنات سدیم کلرات سدیم هیدروکسید سدیم سیلیکات سدیم سولفات سدیم اسید سولفوریک دی اکسید تیتانیوم |
همه این مواد شیمیایی و ترکیبات در تمام جنبه های صنایع شیمیایی از جمله کاتالیزورها، رنگدانه ها، سورفکتانت ها، پوشش ها، دارو، سوخت و کشاورزی کاربرد دارند. محصولات این صنعت به عنوان مواد شیمیایی اساسی برای فرآیندهای صنعتی (مانند اسیدها، بازها، نمک ها، عوامل اکسید کننده، گازها، هالوژن ها)، افزودنی های شیمیایی (رنگدانه ها، فلزات قلیایی، رنگ ها) و محصولات نهایی (کودها، شیشه، مصالح ساختمانی) استفاده می شود. .
صنعت مواد شیمیایی معدنی
از دیدگاه صنعت، دو دسته اصلی از مواد شیمیایی معدنی وجود دارد: مواد شیمیایی قلیایی (شامل خاکستر سودا، سود سوزآور و کلر مایع) و ترکیبات معدنی اساسی (فلورید آلومینیوم، کاربید کلسیم، کلرات پتاسیم، دی اکسید تیتانیوم و غیره).
مواد شیمیایی قلیایی
صنعت کلر- قلیایی جزء عظیمی از اقتصاد جهانی است. در اصل، آب نمک (آب نمک، NaCl) از طریق الکترولیز برای تولید سود سوزآور (هیدروکسید سدیم، NaOH)، گاز کلر (Cl2) و گاز هیدروژن (H2) تقسیم میشود.
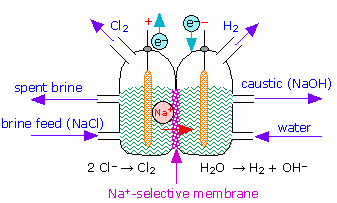
واکنش سلولی فوق به صورت زیر است:
2NaCl + 2H 2 O = Cl 2 + H 2 + 2 NaOH
کلر (Cl2 ) در الکترود مثبت (آند) تولید می شود. هیدروژن (H2 ) و هیدروکسید سدیم (NaOH، سوزاننده) در الکترود منفی (کاتد) تولید می شوند. این سه ماده خوراکی برای تولید سفید کننده، وینیل ها، و مجموعه ای از محصولات دیگر، از جمله خاکستر سودا (کربنات سدیم، Na2CO3) هستند، همانطور که در اینجا ذکر شده است:
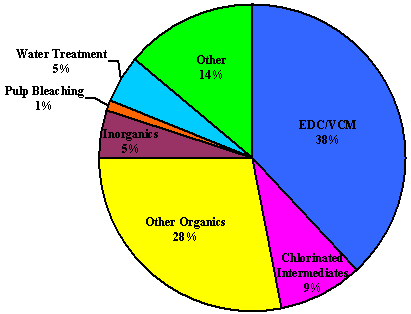
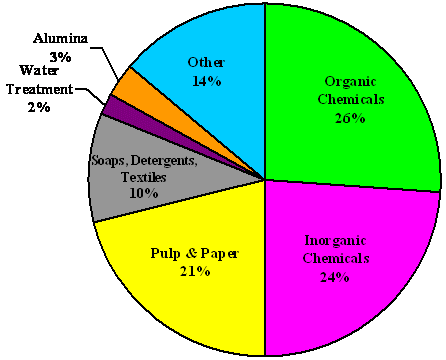
کلر از سود سوزآور استفاده می کند
ترکیبات معدنی اساسی
سنتز معدنی، فرآیند سنتز ترکیبات شیمیایی معدنی، برای تولید بسیاری از ترکیبات شیمیایی معدنی پایه استفاده می شود. به عنوان مثال، یک رنگدانه معدنی یک اکسید فلزی طبیعی یا مصنوعی، سولفید یا نمک دیگری است که در طی فرآوری در دمای 1200 درجه فارنهایت تا 2100 درجه فارنهایت (650 درجه سانتی گراد تا 1150 درجه سانتی گراد) کلسینه می شود. رنگدانه های معدنی دارای پایداری در برابر حرارت، پایداری نور، مقاومت در برابر آب و هوا و مقاومت در برابر مهاجرت هستند.
این ترکیبات به طور گسترده در بسیاری از کاربردها، از جمله آبکاری، رنگ و ریختهگری دقیق، تقطیر الکلی و کاغذسازی استفاده میشوند. دی اکسید گوگرد و سولفیت ها مواد شیمیایی معدنی هستند که به عنوان نگهدارنده استفاده می شوند. از ترکیبات معدنی به عنوان افزودنی خوراک، حشره کش، نگهدارنده چوب و ضد عفونی کننده نیز استفاده می شود.
انواع ترکیبات معدنی

چند نوع (یا گروه) کلیدی از ترکیبات معدنی وجود دارد، از جمله:
ترکیبات معدنی زیستی - ترکیبات طبیعی و مصنوعی که شامل عناصر فلزی متصل به پروتئین ها و سایر مواد شیمیایی بیولوژیکی است.
ترکیبات خوشه ای - مجموعه ای از اتم های محدود. اندازه آنها متوسط است، معمولاً بزرگتر از یک مولکول و در عین حال بیشتر از یک جامد توده ای تعریف شده است.
ترکیبات هماهنگی - ترکیباتی که یون مرکزی، معمولاً یک فلز واسطه، توسط گروهی از آنیون ها یا مولکول ها احاطه شده است.
Organo Metallics - ترکیباتی که شامل اتمهای کربن هستند که مستقیماً به یک یون فلزی پیوند دارند.
حالت جامد - کلاس متنوعی از ترکیبات که در دما و فشار استاندارد جامد هستند و خواص منحصر به فردی را به عنوان نیمه هادی ها و غیره از خود نشان می دهند.
شیمی واکنش معدنی
بیشتر واکنشهای شیمیایی معدنی به چهار دسته کلی تقسیم میشوند: واکنشهای ترکیبی، واکنشهای تجزیه، واکنشهای جابهجایی منفرد و واکنشهای جابهجایی دوگانه.
واکنش های ترکیبی
واکنش هایی که در آن دو ماده با هم ترکیب می شوند و ماده سومی را تشکیل می دهند. یک مثال ساده، واکنش دو عنصر برای تشکیل ترکیبی از عناصر است و به شکل کلی نشان داده شده است:
A + B ---> AB
مثالها عبارتند از:
2Na(s) + Cl2(g) -> 2NaCl(s)
8 Fe + S8 ---> 8 FeS
واکنش های تجزیه
واکنش هایی که در آن یک ترکیب منفرد واکنش نشان می دهد و دو یا چند ماده ایجاد می کند. برای تجزیه یک ترکیب، اغلب نیاز به افزایش دما است. نمونه ای از واکنش تجزیه تجزیه اکسید جیوه (II) به جیوه و اکسیژن در هنگام گرم شدن ترکیب است. یک ترکیب همچنین می تواند به یک ترکیب و یک عنصر یا دو ترکیب تجزیه شود.
واکنش های جابجایی منفرد
واکنش هایی که در آن یک عنصر با عنصر دیگری در یک ترکیب معامله می کند. این واکنش ها به شکل کلی هستند:
A + BC ---> AC + B
مثالها عبارتند از:
منیزیم جایگزین هیدروژن در آب برای ساخت هیدروکسید منیزیم و گاز هیدروژن:
Mg + 2 H2O ---> Mg(OH)2 + H2
تولید بلورهای نقره زمانی که یک نوار فلزی مسی در نیترات نقره فرو میرود:
Cu(s) + 2AgNO3 (aq) -> 2Ag (s) + Cu(NO3)2 (aq)
واکنش های جابجایی دوگانه
واکنشهایی که در آن آنیونها و کاتیونهای دو مولکول مختلف جای خود را عوض میکنند تا دو ترکیب کاملاً متفاوت را تشکیل دهند. این واکنش ها به شکل کلی هستند:
AB + CD ---> AD + CB
به عنوان مثال واکنش نیترات سرب (II) با یدید پتاسیم برای تشکیل یدید سرب (II) و نیترات پتاسیم است:
Pb(NO3)2 + 2 KI ---> PbI2 + 2 KNO3
نوع خاصی از واکنش جابجایی مضاعف زمانی اتفاق میافتد که اسید و باز با یکدیگر واکنش میدهند. یون هیدروژن موجود در اسید با یون هیدروکسیل در باز واکنش داده و باعث تشکیل آب می شود. به طور کلی محصول این واکنش مقداری نمک یونی و آب است:
HA + BOH ---> H2O + BA
یک مثال واکنش هیدروبرومیک اسید (HBr) با هیدروکسید سدیم است:
HBr + NaOH ---> NaBr + H2O
اسیدها، بازها و نمک ها
بسیاری از ترکیبات معدنی به صورت اسید، باز یا نمک در دسترس هستند. چندین محصول کلیدی و ویژگی عملکرد توجه داشته باشید:

اسیدهای معدنی
تمام اسیدهای معدنی غلظت هیدروژن را در محلول آبی افزایش می دهند. محصولات کلیدی عبارتند از:
اسید کربنیک - یک اسید معدنی ضعیف.
هیدروکلریک اسید (HCl) - یک اسید معدنی بسیار خورنده و قوی با کاربردهای فراوان.
هیدروفلوریک اسید (HF) - یک اسید معدنی ضعیف است که با سیلیکات، شیشه، فلزات و نیمه فلزات بسیار واکنش پذیر است.
اسید نیتریک (HNO3) - یک اسید معدنی قوی بسیار خورنده و سمی است.
اسید اگزالیک - یک اسید معدنی نسبتاً قوی است که معمولاً در تمیز کردن و سفید کردن استفاده می شود.
اسید فسفریک - یک اسید معدنی قوی در نظر گرفته نمی شود. به صورت جامد به عنوان یک ماده معدنی یافت می شود و مصارف صنعتی زیادی دارد.
اسید سولفوریک - یک اسید معدنی بسیار خورنده. محلول در آب است و به طور گسترده مورد استفاده قرار می گیرد.
پایه های معدنی
تمام بازهای معدنی غلظت هیدروکسید را در یک محلول آبی افزایش می دهند
هیدروکسید آمونیوم (آب آمونیاک) - محلولی از آمونیاک در آب.
هیدروکسید کلسیم (آهک آب) - یک پایه ضعیف با کاربردهای صنعتی فراوان.
هیدروکسید منیزیم - هنگامی که به شکل معدنی جامد یافت می شود به عنوان بروسیت شناخته می شود.
بی کربنات سدیم (جوش شیرین) - یک قلیایی ملایم.
هیدروکسید سدیم (سودا سوز آور) - یک پایه معدنی قوی. به طور گسترده ای در محیط های صنعتی و آزمایشگاهی استفاده می شود.
نمک های معدنی
نمک های معدنی مولکول های خنثی و متصل به یون هستند و بر غلظت هیدروژن در یک محلول آبی تأثیری ندارند.
کلرید کلسیم - بسیاری از مصارف صنعتی.
دی کرومات پتاسیم - معمولا به عنوان یک عامل اکسید کننده استفاده می شود.
کلرید سدیم - نمک خوراکی رایج مورد استفاده در صنایع غذایی.
بلوک های ساختمانی غیر آلی
ترکیبات معدنی، در معنای وسیعتر، از یک جزء یونی (یک عنصر از جدول تناوبی نشان داده شده در زیر) و یک جزء آنیونی تشکیل شدهاند. تعداد بسیار زیادی از ترکیبات به طور طبیعی به وجود می آیند در حالی که سایر ترکیبات ممکن است سنتز شوند. در همه موارد، خنثی بودن بار ترکیب، کلید ساختار و خواص ترکیب است.
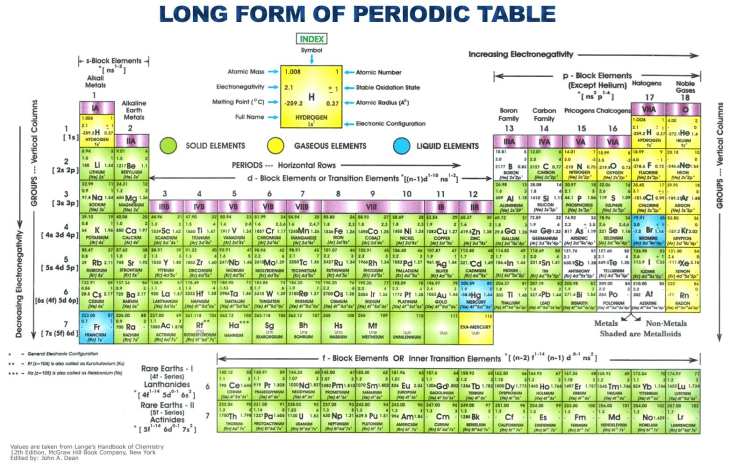
ترکیبات یونی ممکن است از ترکیب یک جزء یونی و یک جزء آنیونی تولید شوند که در آن قوانین استوکیومتری و سایر موارد رعایت شود. بلوک های سازنده یونی برای چنین ترکیباتی عبارتند از:
گروه | توضیحات | نمونه ها |
فلزات قلیایی | گروه 1 جدول تناوبی | لیتیوم (Li) سدیم (Na) پتاسیم (K) روبیدیم (Rb) سزیم (Cs) فرانسیوم (Fr) |
زمین های قلیایی | گروه 2 جدول تناوبی | بریلیم (Be) منیزیم (Mg) کلسیم (Ca) استرانسیوم (Sr) باریم (Ba) رادیوم (Ra) |
متالوئیدها | نیمه فلزاتی که نمی توان آنها را به وضوح به عنوان فلز یا غیرفلز تعریف کرد | بور (B) سیلیکون (Si) ژرمانیوم (جنرال الکتریک) آرسنیک (As) آنتیموان (Sb) تلوریم (Te) پولونیوم (Po) |
غیر فلزات | عناصری که هادی ضعیف با چگالی و نقطه ذوب کم هستند | هیدروژن (H) کربن (C) نیتروژن (N) فسفر (P) اکسیژن (O) گوگرد (S) سلنیوم (Se) |
فلزات انتقالی | گروه های 3 تا 10 جدول تناوبی | نقره (Ag) طلا (Au) پلاتین (Pt) آهن (آهن) تیتانیوم (Ti) |
سایر فلزات | گروه های 13، 14 و 15 جدول تناوبی | آلومینیوم (Al) گالیم (Ga) ایندیوم (در) قلع (Sn) تالیم (Tl) سرب (Pb) بیسموت (بی) |
زمین های کمیاب | مجموعه ای از هفده عنصر | اسکاندیم ایتریوم لانتانیدها |
و اجزای آنیونی عبارتند از:
گروه | توضیحات | نمونه ها |
هالوژن ها | گروه 17 جدول تناوبی | فلوئور (F) کلر (Cl) برم (Br) ید (I) استاتین (در) |
غیر فلزات | عناصری که هادی ضعیف با چگالی و نقطه ذوب کم هستند | هیدروژن (H) کربن (C) نیتروژن (N) فسفر (P) اکسیژن (O) گوگرد (S) سلنیوم (Se) |
متالوئیدها | نیمه فلزاتی که نمی توان آنها را به وضوح به عنوان فلز یا غیرفلز تعریف کرد | بور (B) سیلیکون (Si) ژرمانیوم (جنرال الکتریک) آرسنیک (As) آنتیموان (Sb) تلوریم (Te) پولونیوم (Po) |
اکسوانیون ها | ترکیباتی که حاوی یک آنیون چند اتمی ساده با اکسیژن هستند | بورات ها (BO3، BO4) برومات ها (BrO3) کربناتها (CO3) کلرات ها (ClO3) سیانات ها (NCO) نیترات (NO3) فسفات ها (PO4) سیلیکات (SiO4) سولفات ها (SO4) |
دیگر | سیانیدها (CN) هیدروکسیدها (OH) |
خواص
مشخصات مواد شیمیایی معدنی شامل مترادف ها، وزن مولکولی، فرمول/ساختار، گروه عاملی، شماره ثبت خدمات چکیده شیمیایی (CAS)، وقوع، موارد استفاده و کاربردها، خواص فیزیکی، روش های آماده سازی با معادلات شیمیایی، واکنش های شیمیایی، و تجزیه و تحلیل شیمیایی سلامت می باشد.
ترکیبات معدنی ممکن است بر اساس خواص آنها طبقه بندی شوند، از جمله:
فرم مواد
گاز
مایع (یا محلول)
کلوئید، امولسیون یا پراکندگی
پودر
جامد حجیم (پلت، پولک، گرانول)
نقطه اشتعال پایین ترین دمایی است که در آن یک مایع می تواند مخلوط قابل اشتعال در هوا در نزدیکی سطح مایع ایجاد کند. هر چه نقطه اشتعال کمتر باشد، مشتعل شدن مواد آسان تر است.
خلوص درصد وزنی جزء(های) اصلی مانند %Al2O3 برای سرامیک آلومینا است.
غلظت مقدار واقعی یک ماده شیمیایی یا ترکیب موجود در جامد، مایع یا گاز توده است. به صورت درصد بیان می شود.
منابع: ویکی پدیا
globalspec
