الکترود سنج های خاص یونی
به روز رسانی شده در ۱۴۰۴/۱۱/۱۳ زمان مطالعه 10 دقیقه
الکترود سنج های مخصوص یون ابزاری هستند که فعالیت یونی را در یک نمونه اندازه گیری می کنند.
نمایش تمام سازندگان الکترود سنج های خاص یونی
الکترود سنج های خاص یونی (ISE) میلی ولت متری هستند که با الکترودهای انتخابی یونی (همچنین به عنوان الکترودهای یونی خاص [SIE] شناخته می شوند) ارتباط دارند. این دستگاه ها بر اساس اصولی مشابه آنچه که توسط ابزارهای pH استفاده می شود، عمل می کنند . در واقع، الکترودهای pH صرفاً الکترودهای انتخابی یونی هستند که به طور خاص به یون های H+ در یک محلول پاسخ می دهند.
فعالیت در مقابل تمرکز

در حالی که مترهای ISE برای اندازه گیری غلظت یون در نظر گرفته می شوند، در واقع آنها فعالیت ترمودینامیکی را اندازه گیری می کنند که گاهی اوقات به عنوان "غلظت موثر" نامیده می شود. فعالیت هنگام تعیین غلظت یون مهم است زیرا فعالیت یون، بیشتر از بسیاری از مولکولهای داخل یک محلول، عمیقاً تحت تأثیر محلول اطراف است. به عبارتی بسیار ساده، «فعالیت» برای توصیف غلظت مؤثر یک مولکول در یک ماده واقعی استفاده میشود، در حالی که غلظت واقعی تنها زمانی قابل استفاده است که به مواد ایدهآل اشاره شود.
تداخل
مترها و پروب های ISE برای تشخیص انتخابی یون های خاص طراحی شده اند، اما یون های دیگر نیز ممکن است به طور سهوی شناسایی شوند. این یون های تداخلی گاهی اوقات به عنوان مداخله کننده نامیده می شوند، در حالی که یون هایی که باید شناسایی شوند به عنوان عوامل تعیین کننده نامیده می شوند.
سازندگان به ترجیح الکترود برای تعیین کننده به عنوان انتخابی اشاره می کنند . هنگامی که به عنوان یک نسبت بیان می شود به عنوان ضریب انتخاب نامیده می شود . به عنوان مثال، الکترودی که برای حس کردن یونهای پتاسیم طراحی شده است ممکن است ضریب انتخابی 385:1 نسبت به یونهای سدیم داشته باشد، به این معنی که الکترود نسبت به K + 385 برابر بیشتر از Na + انتخاب میشود .
اندازه گیری و کاربردها
متر الکترود مخصوص یون ممکن است برای اندازه گیری یکی از چندین نوع مختلف یون، بسته به الکترود مورد استفاده، پیکربندی شود. عناصری که معمولاً اندازهگیری میشوند شامل پتاسیم، آمونیوم، کلسیم، سدیم، لیتیوم، نیترات/نیتریت، کلرید و یدید هستند. اکثر سازندگان محدوده اندازه گیری را بر حسب قسمت در میلیون (ppm) مشخص می کنند که یک واحد غلظت رایج است.

متر ISE به طور کلی در بسیاری از انواع مختلف کاربردهای آزمایش شیمیایی استفاده می شود، در حالی که اندازه گیری فلوراید، کلرید، پتاسیم و سایر یون ها در آزمایش کیفیت آب رایج است. از آنجایی که متر ISE فعالیت یون را اندازه گیری می کند و می تواند در زمان واقعی به روز شود، اغلب در تحقیقات بیوشیمیایی و بیوفیزیکی استفاده می شود.
مانند بسیاری از ابزارهای کیفیت آب، مترهای ISE نیز ممکن است برای اندازه گیری سایر کیفیت ها با استفاده از پروب های مختلف، از جمله pH، سختی، هدایت، پتانسیل کاهش اکسیژن (ORP) و گازهای محلول قابل تنظیم باشند.
ساخت و بهره برداری کنتور
مترهای الکترود انتخابی یونی ولت مترهای نسبتاً ساده ای هستند که ورودی دو الکترود را می پذیرند: یک الکترود حسگر و یک الکترود مرجع. این دو الکترود ممکن است در یک پروب ساخته شوند یا از دو پروب جداگانه استفاده کنند.
الکترود حسگر دارای یک غشای تخصصی است که به گونهای طراحی شده است که تنها توسط یونی که باید اندازهگیری شود، نفوذپذیر باشد. هر الکترود حاوی یک عنصر داخلی است که معمولاً از نقره ساخته شده و در یک محلول الکترولیت غوطه ور است. الکترود مرجع به طور مشابه ساخته شده است، اما شامل یک غشای قابل نفوذ برای حفظ ولتاژ مرجع ثابت نیست. همانطور که یون ها از طریق غشاء مبادله می شوند، عنصر نقره فعالیت یون را حس می کند و در ارتباط با ولتاژ الکترود مرجع، یک پتانسیل الکتریکی را به متر می دهد.
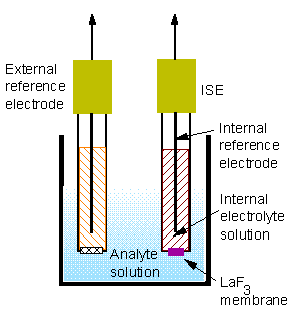
یک الکترود حسگر (انتخابی فلوراید) و الکترود مرجع خارجی. فلش های سیاه نشان دهنده ولتاژهایی است که به کنتور ارسال می شود.
فاکتور فرم
متر ISE ممکن است فاکتورهای شکل متفاوتی داشته باشد. انتخاب این عوامل شکل بستگی به کاربرد مورد نظر متر دارد.
مترها را می توان در درجه اول به دو نوع طبقه بندی کرد: رومیزی و قابل حمل. واحدهای رومیزی برای قرار گرفتن بر روی یک سطح صاف طراحی شده اند، در حالی که کنتورهای قابل حمل به صورت دستی و طوری طراحی شده اند که به راحتی برای آزمایش میدانی حمل شوند. هر دو از پروب های خارجی متصل به واحد استفاده می کنند.


یک متر رومیزی (سمت چپ) و یک متر قابل حمل.
عملیات کنتور
پس از دریافت داده های پتانسیل الکتریکی، یک متر ISE ممکن است از یکی از چندین روش محاسبه مختلف برای تعیین فعالیت یونی استفاده کند. یون ها و محلول های خاص اغلب به روش های خاص از نظر دقت و سهولت استفاده بهتر پاسخ می دهند. نمونه تست در زیر لیست شده است.
پتانسیومتری مستقیم : آمونیاک در آب، برمید، کلسیم در خاک یا آب، کلرید، سیانید، فلوراید، نیترات، سولفیدها.
افزایشی : بیشتر یونهای موجود در شراب و آبجو، پتاسیم، کلریدهای سرم، سولفاتها، فلورایدها، نقره.
تیتراسیون : آرسنیک، کادمیوم، سولفات ها.
پتانسیومتری مستقیم
پتانسیومتری مستقیم رایج ترین روش تحلیلی برای تعیین غلظت یون است. این روش بر معادله Nernst متکی است که بر اختلاف پتانسیل در یک غشای خاص یونی و یک الکترود مرجع حاکم است:
65643f78127749f889d1cc5ef2eeb4ae.gif)
کجا:
E = پتانسیل
E 0 = ثابت ویژه ISE
R = ثابت گاز
T = دما
n = بار یون
F = ثابت فارادی
به عبارت ساده تر، معادله بیان می کند که اختلاف پتانسیل اندازه گیری شده متناسب با لگاریتم غلظت یون است. با اندازه گیری تعدادی محلول با غلظت های یونی شناخته شده، روابط بین پتانسیل و غلظت را می توان به راحتی رسم کرد و با استفاده از این داده ها می توان غلظت یک ماده ناشناخته را تعیین کرد.
بیشتر کنتورهای مبتنی بر ریزپردازنده مدرن با دادههای غلظت مستقیم از پیش برنامهریزی شدهاند، در نتیجه رسم دستی منسوخ میشود.
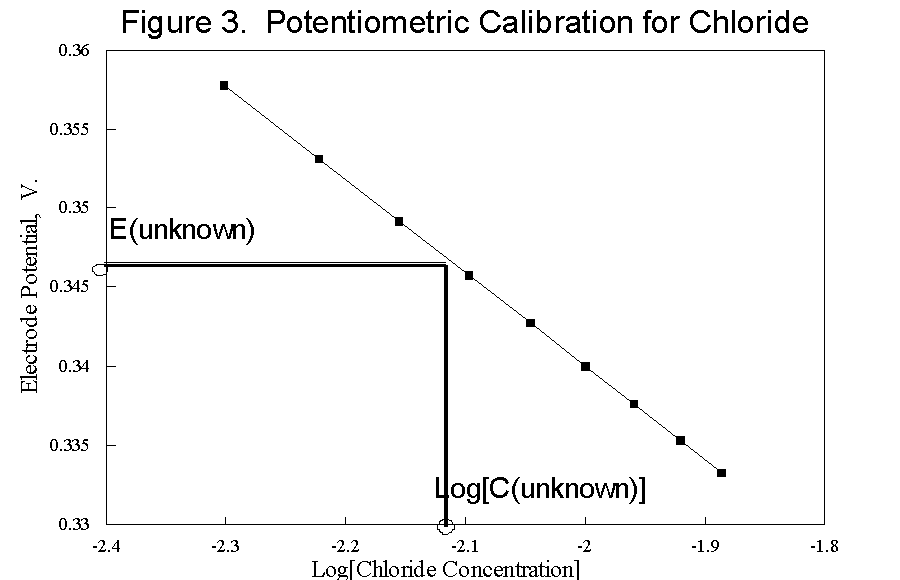
یک منحنی کالیبراسیون ISE معمولی برای کلرید. این داده ها در کنتورهای دیجیتال مدرن از قبل برنامه ریزی شده اند.
تحلیل افزایشی
تکنیکهای افزایشی زمانی استفاده میشوند که تعدادی اندازهگیری متفاوت با الکترودهای مختلف انجام شود. در این مورد، تلاشهای کالیبراسیون چندگانه مورد نیاز برای انجام اندازهگیریهای پتانسیومتری مستقیم دقیق، دشوار خواهد بود.
نمونه ای از آنالیز افزایشی روش جمع شناخته شده است. در این روش، پتانسیل یک حجم مشخص از یک محلول مجهول اندازه گیری می شود. سپس حجم کمی (حدود 10 درصد از محلول مجهول) از محلول شناخته شده به محلول مجهول اضافه می شود و پتانسیل الکترود مجددا اندازه گیری می شود. اختلاف پتانسیل (ΔE) را می توان با استفاده از فرمول زیر پیدا کرد.
857821c9143f4b938a74d2b793d0df0d.gif)
کجا:
C U = غلظت ماده ناشناخته
C S = غلظت ماده شناخته شده (استاندارد)
V S = حجم استاندارد
V U = حجم ماده ناشناخته
ΔE = تغییر پتانسیل الکترود (بر حسب میلی ولت)
S = شیب الکترود
سایر روش های افزایشی شامل تفریق شناخته شده، جمع نمونه و تفریق نمونه است که همگی به اختلاف پتانسیل ناشی از دستکاری مواد شناخته شده و ناشناخته بستگی دارند.
از آنجایی که روشهای افزایشی تنها به یک محلول استاندارد و دو اندازهگیری مجزا نیاز دارند، برای اندازهگیریهای یکباره و آزمایش مواد ناپایدار مفید هستند. با این حال، یک اشکال عمده این واقعیت است که غلظت تقریبی ماده ناشناخته باید شناخته شود تا بتوان یک استاندارد مناسب را قبل از انجام هر گونه اندازه گیری انتخاب کرد.
تیتراسیون
اندازه گیری ISE با استفاده از دو روشی که در بالا توضیح داده شد نسبتاً نادقیق است و معمولاً منجر به دقت بین 2-8٪ می شود. برای برخی از اندازهگیریها، تکنیکهای تیتراسیون میتوانند این مقدار را تا حدود 1 درصد دقت کاهش دهند.
روش تیترومتری شامل افزودن یک معرف به ماده ناشناخته است. با پیشرفت واکنش و پیوند معرف با یونهایی که باید اندازهگیری شوند، یونها در واکنش با الکترود مخصوص یون شکست خواهند خورد. در نقطه پایانی واکنش، یک تغییر ناگهانی در پتانسیل الکتریکی رخ می دهد که روی الکترود ثبت می شود. در این مرحله می توان حجم معرف را تعیین کرد و برای محاسبه غلظت مجهول استفاده کرد.
تیتراسیون پتانسیومتری به صورت خودکار بسیار ساده است و برای اندازه گیری به الکترودهای تخصصی نیاز دارد.
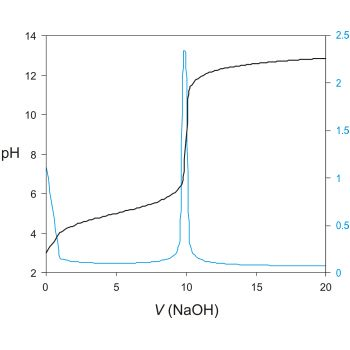
یک منحنی تیتراسیون پتانسیومتری معمولی برای هیدروکسید سدیم. به اسپایک بالقوه در نقطه پایانی تیتراسیون توجه کنید.
استانداردها
استانداردها اغلب هنگام استفاده یا کالیبره کردن الکترود مترهای خاص یونی استفاده می شوند. استانداردهای نمونه عبارتند از:
ASTM D4127 - اصطلاحات استاندارد مورد استفاده با الکترودهای انتخابی یونی
BS 7310 - مشخصات الکترودهای انتخاب کننده یون [...] و متر الکترودهای انتخابی یون برای تعیین یون ها در محلول
ISO 9517 - سنگ معدن آهن - تعیین کلرید محلول در آب به روش الکترود انتخابی یونی
منبع
