مواد بایو
به روز رسانی شده در ۱۴۰۴/۱۲/۳ زمان مطالعه 10 دقیقهتاریخچه مواد زیستی به مه زمان برمیگردد: انسانها همیشه از مواد برونزا برای تسهیل بهبود زخم و تلاش برای بازیابی بافتها و اندامهای آسیبدیده استفاده میکردند. امروزه، طیف گسترده ای از مواد به صورت تجاری در دسترس هستند و بسیاری دیگر برای حفظ و بازیابی عملکردهای بدن تحت بررسی هستند. نیازهای نوظهور بالینی باعث توسعه بیومواد جدید شد و اخیراً بیومواد کشف شده امکان اجرای کاربردهای بالینی جدید را فراهم کرد. تعریف بیومواد به عنوان موادی که به طور خاص برای مصارف زیست پزشکی در نظر گرفته شده اند، زمانی مطرح شد که پذیرفتند که آنها باید دارای یک ویژگی اساسی باشند: زیست سازگاری. در ابتدا، زیست سازگاری عمدتا با مواد بیولوژیکی خنثی همراه بود. در حدود دهه 1970، زیست فعالی برای اولین بار کشف شد و در نتیجه تعریف زیست مواد گسترش یافت. در حال حاضر، شامل مواد مشتق شده بیولوژیکی و بافت های بیولوژیکی نیز می شود. هدف کار حاضر قدم زدن در تاریخ بیومواد با نگاهی به ادبیات علمی منتشر شده در این مورد است. در نهایت، برخی از کاربردهای فعلی بیومواد به طور مختصر به تصویر کشیده شده و بهره برداری آینده از آنها فرضیه می شود.
1. زمانی که تاریخ آغاز شد
استفاده از کلمه "زیست مواد" تا حد زیادی با استفاده عملی از مواد به عنوان مواد زیستی پیش بینی شده بود. در واقع، وجود مواد برون زا در بدن انسان را می توان به ماقبل تاریخ [ 1 ] دانست. نقطه نیزه تعبیه شده در لگن مرد کنویک (حدود 7000 سال قبل از میلاد) و استفاده از ذرات کربن برای خالکوبی نمونه هایی از اجسام خارجی است که توسط میزبان تحمل شده است. همچنین به خوبی شناخته شده است که تا 4000 سال پیش مصریان باستان از نخ های کتانی برای تسهیل بهبود زخم استفاده می کردند. کتگوت در قرون وسطی توسط اروپایی ها به عنوان ماده بخیه استفاده می شد [ 2 ]. در آفریقای جنوبی و هند، از سر مورچه های بزرگ و گزنده برای بستن لبه های زخم به هم استفاده شد [ 1 ]. یک بررسی تاریخی جالب در مورد مواد برای بخیه زدن توسط Muffly، Tizzano و Waters [ 3 ] منتشر شد . بخیه های فلزی به یونان باستان باز می گردد، زمانی که پزشک، جراح و فیلسوف جالینوس از پرگامون (قرن دوم پس از میلاد) سیم های طلایی را توصیف کرد که به عنوان بند استفاده می شود. در طول قرن ها، فلزات دیگری مورد بهره برداری قرار گرفته اند: سرب و نقره در میان دیگران، با و بدون شواهدی از واکنش های نامطلوب.
مواردی از کاربردهای مورد نظر مواد غیر بیولوژیکی برای ترمیم بافت استخوان را می توان به جراحان اینکا نسبت داد که شکستگی های جمجمه را با صفحات طلایی ترمیم کردند. علاوه بر این، جمعیتهای باستانی مایاها از صدفهای دریایی برای ایجاد دندانهای مصنوعی استفاده میکردند که به درستی به یکپارچگی استخوانی دست یافتند [ 4 ، 5 ]. علاوه بر این، 4000 سال پیش، چینیها چوب بامبو را به شکل دندانهای طبیعی حک میکردند تا درست مانند ایمپلنتهای فعلی دندان، در فکها قرار داده شوند. مصریان از فلزات گرانبها برای ایمپلنت دندان استفاده می کردند [ 6 ]. اخیراً از آهن برای تولید دندان مصنوعی در اروپا (حدود 200 AC) استفاده شده است [ 7 ]. جدول زمانی که مهمترین نقاط عطف در تاریخ بیومواد را نشان می دهد در شکل 1 نشان داده شده است . جدول 1 برخی از مرتبط ترین کاربردهای بیومواد را برای استفاده بالینی فهرست می کند.
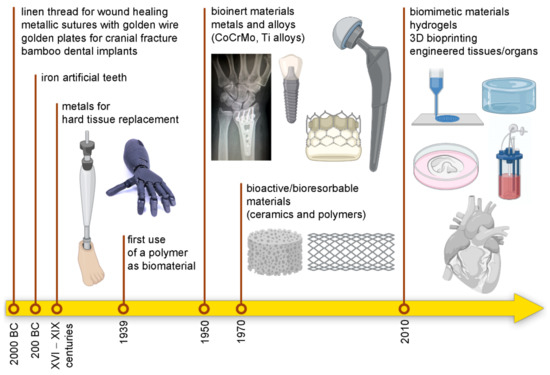
شکل 1. تاریخچه بیومواد: از جایگزینی تا بازسازی.
جدول 1. طبقات بیومواد و مرتبط ترین کاربردهای بالینی آنها.

علاوه بر این، هدف جایگزینی بخشهای بیمار/ آسیبدیده بدن انسان قرنهاست که دنبال میشود. در طول قرن شانزدهم، Gaspare Tagliacozzi و دیگر جراحان پلاستیک پیشگام با موفقیت از فلپ های پوستی خودزا برای جایگزینی بینی های از دست رفته استفاده کردند [ 8 ]. تمام این اعمال جراحی اولیه بدون هیچ گونه آگاهی از مشکلات و محدودیت های مربوط به علم مواد و پدیده های بیولوژیکی انجام شده است. علاوه بر این، هیچ دانشی از عقیم سازی، واکنش ایمنی، التهاب و تجزیه زیستی در آن زمان ها در دسترس نبود [ 1 ]. با این حال، موفقیت "ناخودآگاه" آنها به وضوح نشان می دهد که بدن انسان توانایی چشمگیری برای تطبیق خود و قرار دادن مواد خارجی دارد. این امکان سفر در مسیر تکامل بیومواد را پیش از در نظر گرفتن فعل و انفعالات اساسی بین بدن و مواد کاشته شده فراهم کرد. بررسی سیستماتیک آن تنها حدود 150 سال پیش آغاز شد، زمانی که دانشمندان و پزشکان شروع به ارزیابی علمی نحوه واکنش بدن به حضور مواد برون زا کردند. سپس بهره برداری عملی از مواد به عنوان مواد زیستی با موضوع زیست سازگاری مواجه شد.
2. زیست سازگاری به عنوان آیتم حیاتی
ارزیابی زیست سازگاری یک روش پیچیده با هدف بررسی ظرفیت یک ماده معین برای جلوگیری از واکنش های نامطلوب و همچنین انجام صحیح عملکرد مورد نظر در هنگام تماس با (یا وارد کردن) محیط زیستی است. برخی از مفاهیم اساسی اما اساسی مربوط به زیست سازگاری در FDA [ 9 ] موجود است: شایسته است اشاره کنیم که "FDA زیست سازگاری کل دستگاه و نه فقط مواد جزء را ارزیابی می کند". به طور مشابه، ISO 10993-1 معیارهایی را برای ارزیابی بیولوژیکی تجهیزات پزشکی تعیین می کند، و دوباره تأیید می کند که آزمایش های بیولوژیکی باید "بر روی دستگاه پزشکی نهایی، یا نمونه های معرف از دستگاه نهایی یا مواد پردازش شده به همان روشی که نهایی شده است انجام شود. دستگاه پزشکی (از جمله عقیم سازی، در صورت نیاز)» [ 10 ].
بنابراین، اصطلاح "زیست سازگاری" نه تنها باید شامل آنچه معمولا به عنوان "سازگاری بیولوژیکی" گفته می شود، بلکه یک ارزیابی عملکردی از کل سیستم کاشتنی باشد. موارد زیادی از مواد سازگار بیولوژیکی وجود دارد که از بررسی عملکردی عبور نکرده اند. یک مثال واضح توسط تفلون (پلی تترا فلوئورواتیلن) نشان داده شده است: هیچ واکنش بیولوژیکی خاصی ایجاد نمی کند، و بنابراین می توان آن را "از نظر بیولوژیکی" سازگار در نظر گرفت. هنگامی که تفلون برای جایگزینی مفصل گیجگاهی فکی مورد استفاده قرار گرفت، منجر به تکه تکه شدن قابل توجهی شد و پاسخهای سلول غول پیکر جسم خارجی عظیمی را ایجاد کرد که به تدریج ساختارهای مجاور را فرسایش داد [ 11 ]. بنابراین، تفلون با توجه به برنامه پیش بینی شده از نظر "عملکردی" سازگار نیست.
مطمئناً، چندین جنبه زیست سازگاری یک ماده معین را با در نظر گرفتن مدت زمان تماس با همتایان بیولوژیکی تعیین می کند: ترکیب شیمیایی، رفتار مکانیکی و همچنین شکل فیزیکی. با توجه به این مورد اخیر، از خوانندگان دعوت میشود تا مرور نوشته شده توسط TG Moizhes [ 12 ] را مطالعه کنند که در آن سرطانزایی (سرطانزایی ناشی از اجسام خارجی، ظهور سارکومها در مجاورت یک ماده کاشتهشده است) نه تنها به مواد شیمیایی مربوط میشود. ترکیب و همچنین به شکل دیسک های مختلف کاشته شده در یک مدل حیوانی. به طور خلاصه، صفحات پلیمری بسیار تومورزا پس از سوراخ شدن، سرطانزایی کمتری از خود نشان دادند، در حالی که تکه تکه شدن آنها منجر به از دست دادن تقریباً کامل سرطان زایی شد.
واکنش های القا شده توسط فلزات در اوایل قرن نوزدهم از زمانی که فلزات در آن زمان مورد بهره برداری قرار گرفتند، مورد مطالعه قرار گرفت. طلا، نقره، سرب، نیکل و پلاتین در حیوانات مورد مطالعه قرار گرفتند و مشخص شد که پلاتین به خوبی تحمل می شود [ 1 ]. سایر فلزات منجر به خوردگی سریع (آهن و فولاد) شدند. سایر موارد در تغییر رنگ بافت (مس، منیزیم، آلیاژ آلومینیوم، روی و نیکل)؛ برخی دیگر ویژگی های مکانیکی کافی (طلا، نقره، سرب، آلومینیوم) را نشان نمی دهند. آلیاژهای CoCrMo، تیتانیوم و آلیاژهای آن به دلیل زیست سازگاری آنها که با خواص مکانیکی خوب ترکیب شده است، به عنوان نامزدهای امیدوارکننده برای کاربردهای زیست پزشکی پیشنهاد شدند.
در واقع، محدودیت عمده فلزات در تماس با سیالات بیولوژیکی به دلیل خوردگی است، که مجموع پدیده های شیمیایی (الکترو) است که معمولاً در حضور آب و اکسیژن رخ می دهد. پس از کاشت جراحی، تمام دستگاه های فلزی (یعنی پروتزهای مفصلی، صفحات و پیچ ها) در معرض حمله ساختارهای بدن قرار می گیرند که به عنوان یک سیستم دفاعی عمل می کنند. تحت این شرایط، برخی از فلزات اکسید می شوند: آنها یون هایی را آزاد می کنند که می توانند هم به صورت موضعی و هم از نظر سیستمی سمی باشند. در نتیجه، دستگاه تخریب می شود و دیگر نمی تواند عملکرد مورد نظر را به درستی انجام دهد.
مواد پلیمری اخیراً وارد عرصه بیومواد شدند: اولین ماده پلاستیکی (سلولوئید) در دهه 1860 توسعه یافت و سایرین پس از آن [ 13 ]. راتنر و ژانگ اولین استفاده از پلیمر (سلفون) را به عنوان ماده قابل کاشت در سال 1939 تعیین کردند: این پلیمر برای پوشاندن رگهای خونی استفاده شد و باعث ایجاد واکنش فیبروتیک برای محدود کردن گسترش بیشتر آنوریسم شد. جالب توجه است که آلبرت انیشتین دریافت کننده جایزه نوبل با آنوریسم آئورت شکمی تشخیص داده شد و با پوشش سلفون درمان شد [ 14 ]. دو سال بعد، نایلون و پلی (متیل متاکریلات) در داخل بدن آزمایش شدند، سپس پلی اتیلن به دنبال آن [ 1 ].
دنیای مواد پلیمری به طور پیوسته در حال رشد است و در حال حاضر تعداد زیادی از مواد مختلف را شامل می شود که می توانند در اشکال مختلف فیزیکی با ویژگی های فیزیکی متنوع تولید شوند: از جامدات تا الیاف، از ورقه های نازک تا صفحات ضخیم، از سخت تا نرم. اجزاء، از محصولات بی اثر تا بیواکتیو. تکنیکهای تولید اخیراً با معرفی دستگاههای الکتروریسی و چاپگرهای سهبعدی تقویت شدهاند: آنها هر دو به سفارشیسازی پلیمرها با توجه به تعداد فزایندهای از کاربردها کمک میکنند.
جنبه اصلی محدود کننده زیست سازگاری پلیمرها به دلیل فرمول شیمیایی آنها است: آنها همیشه حاوی مواد افزودنی هستند که می توانند در داخل بدن آزاد شوند و منجر به واکنش های نامطلوب شوند. آنها نرم کننده ها، رنگدانه ها، آنتی اکسیدان ها، عوامل پرتوپاک، بازدارنده ها/ آغازگرهای پلیمریزاسیون و البته مونومرها هستند. اثرات نامطلوب آنها در اواسط دهه 1900 مشاهده شد [ 15 ].
سرامیک ها را می توان به عنوان مواد غیر آلی غیر فلزی [ 16 ] تعریف کرد: آنها به طور گسترده به عنوان مواد زیستی به ویژه برای ترمیم دندان و کاربردهای تماس با استخوان استفاده می شوند. در واقع، سرامیک ها به عنوان جایگزینی برای فلزات و پلیمرها با هدف افزایش تثبیت/ادغام استخوان پیشنهاد شدند. به طور کلی، آنها از نظر بیولوژیکی سازگار هستند، به این معنا که آنها بی اثر یا زیست فعال هستند، اما واکنش های نامطلوب ایجاد نمی کنند. محدودیت مشخص آنها به دلیل سفتی و شکنندگی است که هر دو نشان دهنده اشکالات شدید در بسیاری از کاربردهای عملی هستند. برای تولید پروتزهای ران تنها از آلومینا و زیرکونیا استفاده شده است. جالب توجه است، برخی از سرامیک ها (به عنوان مثال، شیشه های زیست فعال) قادر به ایجاد پیوند مستقیم با بافت های زنده هستند [ 17 ]. یک بررسی جامع در مورد مکانیسم های عمل و کاربردهای عینک های زیست فعال توسط لری هنچ منتشر شد که این دسته از مواد زیستی را در سال 1969 کشف کرد [ 18 ]. به طور خلاصه، فرآیند چند مرحلهای که روی سطوح شیشههای زیست فعال در داخل بدن انجام میشود منجر به تشکیل یک رابط قوی بین استخوان و یک لایه متراکم از هیدروکسی آپاتیت و کربنات آپاتیت میشود [ 19 ]. بنابراین، یک پیوند پایدار با استخوان ایجاد میشود، که منجر به هدایت استخوانی و همچنین القای استخوان میشود [ 20 ].
3. تعاریف در حال تکامل از بیومواد
همانطور که در پاراگراف قبلی توضیح داده شد، مواد زیستی با طیف گسترده ای از ترکیبات و خواص شیمیایی مشخص می شوند و می توان از آنها در کاربردهای بسیار زیادی استفاده کرد. بنابراین، تعریف بدون ابهام آنها بسیار دشوار است.
مارین و همکاران [ 21 ] یکی از اولین تعاریف زیست مواد را به جاناتان کوهن نسبت داد که به سال 1967 برمی گردد [ 22 ]. تصادفی نبود، دکتر کوهن یک جراح ارتوپد بود: مواد اگزوژن سال ها وارد جراحی ارتوپدی شده بودند. او صرفاً «مواد زیستی» را بهعنوان تمام موادی که بهعنوان ایمپلنت استفاده میشوند، به استثنای داروها و بافتهای بیولوژیکی نرم، تعریف کرد. در واقع، این تعریف از استفاده عملی از مواد زیستی در جراحی با تمرکز بر مواد "سخت" که معمولاً در ارتوپدی استفاده می شود، می آید.
در آوریل 1974، انجمن بیومتریال (SFB) به طور رسمی تأسیس شد و سمپوزیوم سالانه افتتاحیه خود را یک سال بعد در دانشگاه کلمسون (SC، ایالات متحده آمریکا) ترتیب داد [ 23 ]. این فرصتی بود برای رسمیت بخشیدن به یک تعریف جدید: "مواد زیستی یک ماده سیستماتیک و از نظر دارویی بی اثر است که برای کاشت در یک سیستم زنده یا ادغام با آن طراحی شده است" [ 24 ]. سپس ماهیت بی اثر مواد زیستی و تفاوت آنها با دارو تایید شد. علاوه بر این، نقش بیومواد برای کاشت دوباره مورد تاکید قرار گرفت. پروفسور هنچ که یکی از اعضای هیئت مدیره SFB بود، این تعریف را پذیرفت، حتی اگر قبلا عینک های فعال زیستی را کشف کرده بود. ظاهراً، در آن زمان عدم وجود پاسخ های نامطلوب به حضور بیومواد در داخل بدن با توجه به اثرات زیست فعال آنها در اولویت بود [ 21 ].
تعریف گسترده تری در سال 1982 در طی «بیانیه کنفرانس توسعه اجماع مؤسسه ملی سلامت در مورد کاربردهای بالینی مواد زیستی» (Bethesda، MD، ایالات متحده آمریکا) فرموله شد: ماده زیستی «ماده ای (غیر از دارو) یا ترکیبی از مواد، مصنوعی است. یا با منشاء طبیعی، که می تواند برای هر دوره زمانی، به عنوان یک کل یا به عنوان بخشی از یک سیستم که درمان، تقویت یا جایگزین هر بافت، اندام یا عملکرد بدن می شود» [ 25 ]. تفاوت با یک دارو حفظ شده است، اما اکنون این تعریف شامل موادی با منشأ "طبیعی" است و مشخص می کند که مواد زیستی برای چه چیزی در نظر گرفته شده اند: آنها بخشی از سیستمی هستند که نه تنها برای جایگزینی، بلکه برای درمان و تقویت بالقوه هر بافت طراحی شده است. هر عضو و هر عملکرد بدن. به نظر ما، این تعریف گامی رو به جلو برای بهره برداری اخیر از مواد زیستی است: آنها نه تنها به سادگی "قطعات یدکی" بدن هستند، بلکه می توانند نقش فعالی را در هر ماهیت خود ایفا کنند. به عنوان یک نتیجه فوری، برنامه های کاربردی ممکن به همان اندازه افزایش می یابد که در دسترس بودن بیومواد افزایش می یابد. از این نظر ، ما تعریف ارائه شده توسط پروفسور دی . نابهنگام بود (و هنوز هم هست)! علاوه بر استفاده کنونی از بافتهای بیولوژیکی از جسد انسان (بانکهای بافت) و از حیوانات (پس از درمانهای شیمیایی)، تکنیکهای مهندسی بافت بهعنوان رویکردهای بسیار امیدوارکننده برای ایجاد بافتها (و اندامهای) زنده با ترکیب سلولها، داربستها (مواد زیستی!) و بیوشیمیایی ظاهر میشوند. سیگنال ها
در طی نهمین کنفرانس اروپایی انجمن اروپایی بیومواد (چستر، انگلستان) در سال 1991، این تعریف که در سال 1982 تصویب شد، از جمله "به منظور حفظ یا بهبود کیفیت زندگی فرد" بهبود یافت . این به چه معناست؟ این به وضوح تأیید می کند که هدف هر بیومتریال نه تنها "بقا" بیمار بلکه حفظ / بهبود کیفیت زندگی آنها است. با توجه به این که WHO پیش بینی می کند که نسبت جمعیت جهان در 60 سال تقریباً دو برابر (از 12٪ به 22٪) بین سال های 2015 و 2050 (28) خواهد شد، می توان تأثیر عظیم این بیانیه را به راحتی درک کرد [ 28 ].
با توجه به پیشرفتهای سریعتر و سریعتر تحقیقات علمی و کاربردهای فنآوری، بهویژه در زمینه زیستپزشکی و همچنین در عمل بالینی، ما آن را مناسب میدانیم که جامعترین تعریف را از بیومواد اعمال کنیم.
4. بیومواد در ادبیات علمی
در حالی که مواد زیستی در ابتدا به عنوان جایگزینی برای جایگزینی بافتهای بیولوژیکی، ساختارهای تشریحی و اندامهای آسیبدیده تصور میشدند، ایده استفاده از آنها برای پزشکی احیاکننده برای اولین بار در دهه 1980 توسط چندین دانشمند از جمله Ioannis Yannas، Joseph Vacanti، Charles Vacanti، Robert Langer و Stephen مطرح شد. بدیلک [ 29 ، 30 ، 31 ، 32 ]. از آن زمان، فعالیتهای تحقیقاتی در زمینه بیومواد برای پزشکی احیاکننده و مهندسی بافت افزایش یافته است. تعداد رکوردهای Scopus در مورد مواد زیستی هم برای جایگزینی و هم برای بازسازی در شکل 2 برای هر سال از 1994 تا 2020 گزارش شده است. به وضوح نشان داده شده است که در حالی که فعالیت های تحقیقاتی روی مواد زیستی برای جایگزینی اندام و بافت حدود صد مقاله در هر سال تولید کرده است. در طول دهه های گذشته، مقالات تحقیقاتی در مورد مواد زیستی برای بازسازی به شدت در حال افزایش است، با تعداد بیش از 1200 مقاله رکورد فقط در سال 2020.
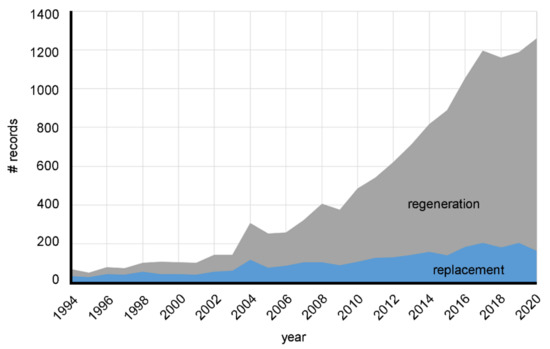
شکل 2. روند تعداد رکوردهای Scopus از سال 1994 تا 2020 برای کلمات کلیدی "جایگزینی مواد زیستی" و "بازسازی مواد زیستی".
به منظور درک بهتر جهت گیری های انجام شده در تحقیقات جهانی مواد زیستی، پایگاه داده Scopus برای مقالات اصلی متن کامل به زبان انگلیسی با استفاده از برخی از کلمات کلیدی که مشخصه این حوزه هستند، مانند "مواد زیستی"، "مواد زیست فعال"، "مواد هوشمند" جستجو شد. "دستگاه های پزشکی"، "زیست سازگاری"، "مهندسی بافت"، "ارگان مهندسی شده"، "جایگزینی مواد زیستی" و "بازسازی بیومواد". تعداد تجمعی رکوردهای Scopus برای هر یک از این کلمات کلیدی تا ژوئن 2021 در شکل 3 a گزارش شده است. روندهای نوظهور در پیشرفت علمی اخیر با مقایسه تعداد رکوردها در سال های 2000 و 2020 برای کلمات کلیدی انتخاب شده، همانطور که در شکل 3 ب نشان داده شده است، برجسته می شوند. طیف وسیعی از بیومواد پیشرفته به طور فزاینده ای با رفتار زیست فعال یا بیومواد هوشمند و پاسخگو به محرک ها با عملکردهای متعدد طراحی می شوند. هیدروژلهای پلیمری به دلیل شباهتهای ساختاری با ماتریکس خارج سلولی بومی (ECM) و همچنین توانایی آنها به عنوان حامل برای تحویل کنترلشده دارو، توجه قابلتوجهی را در چندین کاربرد زیستپزشکی به خود جلب کردهاند. توسعه بافت ها و اندام های مهندسی شده به سرعت مفهوم بیومواد را برای جایگزینی بافت جایگزین می کند. بنابراین، بخشهای زیر از این بررسی بر روی برخی از روندهای نوظهور در بیومواد برای طیف وسیعی از کاربردهای زیست پزشکی متمرکز است.
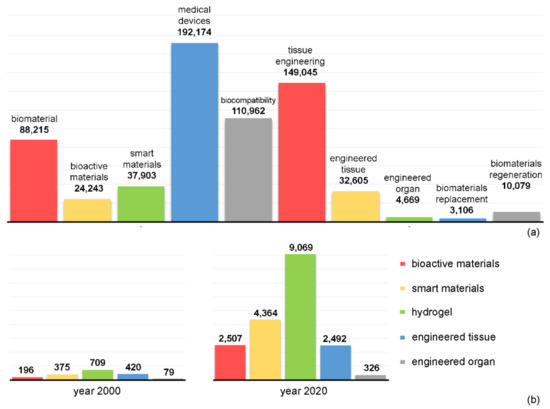
شکل 3. تعداد تجمعی رکوردهای Scopus برای کلمات کلیدی مختلف مرتبط با بیومواد، تا ژوئن 2021 ( a ); مقایسه تعداد رکوردها در سالهای 2000 و 2020 برای کلمات کلیدی انتخاب شده ( b ).
4.1. بیومواد برای مهندسی بافت
از دهه 1980، بیومواد به عنوان داربست هایی که با سلول های زنده کاشته شده بودند، برای بازسازی، نگهداری یا تقویت ساختارهای آناتومیک آسیب دیده یا از دست رفته استفاده شدند. اصطلاح "مهندسی بافت" پس از آن به طور رسمی در کارگاه بنیاد ملی علوم در سال 1988 [ 33 ] به معنای "کاربرد اصول و روشهای مهندسی و علوم زیستی در جهت درک اساسی روابط ساختار-عملکرد در بافتهای طبیعی و پاتولوژیک پستانداران است. و توسعه جایگزین های بیولوژیکی برای بازیابی، حفظ یا بهبود عملکرد بافت. یکی از جنبه های مهم مهندسی بافت، انتخاب مواد زیستی است که داربست ها از آن ساخته می شوند [ 34 ]. داربست ها ساختارهای متخلخل قابل تجزیه ای هستند که ممکن است دارای معماری تصادفی اسفنج مانند یا ساختار بسیار پیچیده با منافذ و کانال های خاص طراحی شده باشند که برای چسبندگی، تکثیر و رشد سلولی مناسب است. آنها در نظر گرفته شده اند که پس از کاشت تخریب شوند در حالی که با بافت اتولوگ تازه رشد کرده جایگزین می شوند. داربست ها همچنین می توانند برای آزادسازی فاکتورهای رشد [ 35 ، 36 ، 37 ] طراحی شوند که تمایز سلولی و رشد بافت را در شرایط آزمایشگاهی یا مهاجرت سلولی به محل زخم را در داخل بدن افزایش می دهند. به لطف عامل دار شدن با عوامل بیوشیمیایی، ماده زیستی داربست باید بتواند به طور انتخابی با گیرنده های خاص بیان شده توسط سلول های هدف در بافت های اطراف، به منظور هدایت مهاجرت آنها به محل آسیب و تحریک چسبندگی، رشد و تمایز آنها تعامل داشته باشد [ 38 ] . پس از کاشت با سلول ها، داربست ها اغلب توسط یک بیوراکتور [ 39 ، 40 ، 41 ، 42 ] تحت تحریک بیوفیزیکی قرار می گیرند، که دستگاهی است که قادر به اعمال محرک های مختلف (مکانیکی، هیدرولیک، الکتریکی، شیمیایی) به سلول ها، به تقلید از شرایط فیزیولوژیکی که انتظار می رود سلول ها در داخل بدن تجربه کنند و در نتیجه بر بیان ژن تأثیر می گذارد و به طور قابل توجهی فعالیت بیوسنتزی را افزایش می دهد.
سرامیک ها و پلیمرهای مصنوعی به طور گسترده ای به عنوان داربست برای مهندسی بافت مورد بررسی قرار گرفته اند. داربست های سرامیکی، بر پایه هیدروکسی آپاتیت (HA) و تری کلسیم فسفات (TCP)، عمدتاً برای بازسازی استخوان استفاده شدند [ 43 ، 44 ، 45 ]. سرامیک ها به دلیل شباهت ترکیبی و ساختاری با فاز معدنی استخوان، سازگاری بیوشیمیایی و بیومکانیکی عالی با بافت استخوان نشان می دهند و به خوبی شناخته شده اند که تمایز و تکثیر استئوبلاست ها را افزایش می دهند [ 46 ، 47 ]. با این حال، تا کنون کاربردهای بالینی آنها برای مهندسی بافت به دلیل رفتار مکانیکی شکننده و مشکلات در تنظیم نرخ تجزیه زیستی آنها محدود بوده است [ 48 ].
چندین پلیمر مصنوعی برای ایجاد داربست برای بازسازی بافت نرم پیشنهاد شده است، به عنوان مثال پلی (α-هیدروکسی استرها) از جمله پلی کاپرولاکتون (PCL)، پلی گلیکولیک اسید (PGA)، پلی لاکتیک اسید (PLA) و کوپلیمر پلی لاکتیک کو-گلیکولیک اسید آنها. (PLGA)، پلی (اترها) از جمله پلی اتیلن گلیکول (PEG)، پلی وینیل الکل (PVA) و پلی اورتان (PU) [ 49 ، 50 ، 51 ]. این پلیمرها خواص فیزیکوشیمیایی و مکانیکی مشابه بافتهای بیولوژیکی از خود نشان میدهند، میتوان آنها را به راحتی با ترکیب ساختاری و هندسه متناسب ساخت و پروفایل تجزیه زیستی آنها را میتوان با تغییر ترکیب شیمیایی آنها کنترل کرد. با این وجود، آنها اغلب فاقد محل های چسبندگی سلولی هستند و به اصلاحات شیمیایی برای تقویت اتصال سلولی نیاز دارند. علاوه بر این، لازم به ذکر است که PEG به راحتی تولید نمی شود: به دلیل ناپایداری حرارتی و واکنش پذیری بالای اکسید اتیلن، راکتورهای پیچیده و اقدامات ایمنی در طول واکنش اتوکسیلاسیون مورد نیاز است [ 52 ].
برای غلبه بر این محدودیت ها، مواد بیولوژیکی مانند کلاژن، پروتئوگلیکان ها، آلژینات، فیبرین، کیتوزان، ژلاتین و آگارز برای ساخت داربست استفاده شد [ 53 ، 54 ، 55 ]. پلیمرهای طبیعی از نظر بیولوژیکی فعال هستند و قادر به افزایش چسبندگی و رشد سلولی عالی هستند. با این وجود، آنها اغلب خواص مکانیکی ضعیفی را نشان می دهند، به ویژه در کاربردهای باربر، و به دلیل تنوع زیستی ذاتی آنها، به راحتی در دسته های همگن با ویژگی های تکرارپذیر به دست نمی آیند.
هر دو پلیمر مصنوعی و طبیعی اغلب برای توسعه هیدروژل ها برای مهندسی بافت استفاده می شوند [ 55 ، 56 ، 57 ، 58 ، 59 ]. هیدروژل ها از زنجیره های پلیمری آبدوست تشکیل شده اند که از طریق پیوندهای کووالانسی یا غیرکووالانسی به هم متصل شده اند. به دلیل توانایی جذب مقادیر زیادی آب و خواص مکانیکی نرم، خواص فیزیکوشیمیایی و مکانیکی قابل مقایسه با بسیاری از بافت های نرم دارند. آنها همچنین می توانند به عنوان مواد تزریقی استفاده شوند که می توانند با شکل بافت آسیب دیده سازگار شوند. هیدروژلهای طبیعی و مصنوعی هر دو میتوانند آمورف یا نیمه کریستالی باشند، در حالی که بسته به پاسخ آنها به محرکهای محیطی، هیدروژلها را میتوان به هیدروژلهای معمولی و هوشمند تقسیم کرد که دومی میتواند رفتار تورمی یا ساختار خود را به طور معکوس تغییر دهد. در پاسخ به نور، فشار، دما، pH، قدرت یونی، میدان الکتریکی یا مغناطیسی و سایر محرک ها [ 56 ]. آنها به دلیل امکان تنظیم خواص مکانیکی آنها، اصلاح ترکیب شیمیایی هیدروژل و اتصال عرضی [ 60 ] مواد مناسبی برای داربست هستند. هیدروژل ها همچنین برای کاشت سلولی مناسب هستند زیرا انزوای ایمنی را ارائه می دهند و به طور همزمان اجازه تبادل گازی و انتشار مواد مغذی را می دهند [ 56 ]. تا به امروز، هیدروژل ها تا حد زیادی به عنوان داربست برای بازسازی استخوان یا بافت نرم، به ویژه در ترمیم غضروف، و برای پانسمان زخم و تحویل دارو یا فاکتور رشد استفاده می شوند [ 61 ].
برای توسعه داربست هایی که شباهت زیادی به بافت های طبیعی دارند، ماتریکس خارج سلولی سلول زدایی شده (dECM) اغلب مورد استفاده قرار می گیرد [ 62 ]. ECM اساساً از مولکولهای ساختاری مانند کلاژن و پروتئوگلیکان تشکیل شده است که مقاومت مکانیکی بافت و رفتار الاستیک را ایجاد میکنند. علاوه بر این، چندین عملکرد سلولی، مانند تکثیر، مهاجرت یا تمایز، توسط ECM تنظیم می شوند [ 63 ].
dECM با حذف تمام اجزای سلولی و هسته ای که مسئول پاسخ ایمنی میزبان هستند و در عین حال ترکیب ECM، ساختار ساختاری، خواص مکانیکی و فعالیت بیولوژیکی را حفظ می کنند، از بافت به دست می آید. چندین روش سلول زدایی با توجه به سه دسته اصلی، یعنی فیزیکی، شیمیایی و بیولوژیکی توسعه یافتند [ 64 ، 65 ، 66 ، 67 ]. روشهای فیزیکی شامل چرخههای انجماد- ذوب، فشار هیدرواستاتیک بالا، الکتروپوراسیون، امواج اولتراسونیک و CO2 فوق بحرانی است . روشهای شیمیایی شامل شویندههای یونی یا غیریونی، محلولهای نمکی هیپرتونیک یا هیپوتونیک، اسیدها و بازها است. روش های بیولوژیکی آنزیم هایی مانند تریپسین، دیسپاز و فسفولیپاز یا نوکلئازهایی مانند DNase را اتخاذ می کنند. انتخاب پروتکل سلول زدایی مناسب یک جنبه کلیدی در هر کاربرد خاص است، با توجه به اینکه هر درمان ممکن است دارای معایبی باشد: به عنوان مثال، روش های فیزیکی می توانند به ماتریکس آسیب وارد کنند، در حالی که روش های شیمیایی ممکن است ترکیب شیمیایی ECM را تغییر دهند [ 64 ، 68 ، 69 ]. چندین جنبه مانند تراکم سلولی، تراکم ماتریکس، ضخامت و مورفولوژی بافت بر فرآیند سلول زدایی و در نتیجه خواص فیزیکوشیمیایی و مکانیکی dECM به دست آمده تأثیر می گذارد. در واقع، ساختار سلول زدایی شده برای حفظ هندسه سه بعدی خود و دست نخورده ماندن کل اندام در نظر گرفته شده است: در نتیجه، قلب مهندسی بافت [ 70 ]، ریه ها [ 71 ]، مجرای ادرار [ 72 ] و مثانه [ 73 ] در سال های اخیر توسعه یافته اند.
4.2. چاپ سه بعدی بیومواد
با توجه به روند رو به افزایش به سمت رویکرد ویژه بیمار، تکنیک های ساخت افزودنی نقش عمده ای در صنعت زیست پزشکی برای تولید چندین دستگاه از جمله ایمپلنت های ارتوپدی و دندان سفارشی، بازسازی جمجمه و جراحی پلاستیک، مدل های آناتومیک برای برنامه ریزی جراحی ایفا می کنند. داربست ها برای مهندسی بافت، پلت فرم های تشخیصی و سیستم های دارورسانی [ 74 ، 75 ، 76 ، 77 ]. چاپ سه بعدی (سه بعدی) یک فرآیند تولید لایه به لایه است که اشیاء سه بعدی را مستقیماً از داده های تشریحی بیمار ایجاد می کند. تصاویر پزشکی به دست آمده با استفاده از توموگرافی کامپیوتری (CT) یا تصویربرداری تشدید مغناطیسی (MRI) را می توان با نرم افزار طراحی به کمک کامپیوتر (CAD) پردازش کرد و سپس به ایمپلنت های سفارشی تبدیل کرد. تکنیکهای چاپ سهبعدی بسته به شکل اولیه مواد جوهر، یعنی فلزات، سرامیکها و پلیمرها، عموماً به سه دسته تقسیم میشوند، یعنی تکنیکهای مبتنی بر مایع، جامد و مبتنی بر پودر [ 76 ]. تکنیکهای مبتنی بر مایع عمدتاً شامل استفاده از نور UV برای درمان انتخابی لایه به لایه پلیمر متقاطع پذیر است. تنظیمات تجاری خاص ممکن است از نظر نوع و طول موج منبع نور، روش اسکن یا نوردهی و ویژگی های مناسب رزین متفاوت باشد. سیستمهای مبتنی بر جامد مستلزم برش و اتصال یا ذوب مواد اکسترود شده به شکل گلولهها، سیمها یا ورقهها هستند، در حالی که از تکنیکهای مبتنی بر پودر، از جمله، از جمله، تف جوشی لیزری انتخابی (SLS) و ذوب پرتو الکترونی (EBM) استفاده میشود. یک پرتو پرانرژی برای اسکن لایه های بعدی پودر برای ایجاد یک شی 3 بعدی [ 78 ].
حوزه مربوط به کاربرد اشیاء چاپ شده سه بعدی مهندسی بافت است زیرا داربست ها را می توان با تخلخل میکرو و ماکرو توسعه داد که در آن سلول ها قادر به اتصال، رشد و تمایز هستند. در این زمینه، چاپ زیستی یک تکنیک ابتکاری است که در آن سلولهای زنده همراه با سایر مواد زیستی، عموماً هیدروژلها، چاپ میشوند [ 79 ، 80 ، 81 ، 82 ]. هدف از چاپ زیستی تولید اندامها و بافتهای کاملاً کاربردی انسان در مقیاس بزرگ است. در حال حاضر سه سیستم اصلی چاپ زیستی به نامهای جوهر افشان، میکرو اکستروژن و چاپگرهای زیستی با کمک لیزر در بازار وجود دارد. در حال حاضر، محدودیتهای اصلی چاپ زیستی شامل استحکام مکانیکی پایین هیدروژلها است که مسئول کاهش توانایی ساخت ساختار سهبعدی است، نیاز به زنده نگه داشتن سلولها در طول فرآیند کلی و در نهایت گنجاندن انواع سلولهای متعدد در بیوئینک، و چالشها. در تنظیم استراتژی طراحی و چاپ به سمت یک ساخت زیستی موثر. در واقع، بلوغ یک بافت پرینت شده سه بعدی به شدت به تخلخل و نفوذپذیری وابسته است و امکان تحویل مواد مغذی، تبادل گاز و عروق را فراهم می کند. علیرغم برخی محدودیتها و مسائل باز، پیشرفتهای آتی در تکنیکهای چاپ زیستی و فرمولبندی جوهرهای زیستی منجر به توسعه بافتهای عملکردی بهینهشده مخصوص بیمار برای پیوند و ترمیم جراحی میشود.
4.3. بیومواد هوشمند
دسته دیگری از بیومواد ابتکاری که رویکردهای پزشکی پیشگام را پیش می برند، آنهایی هستند که نام بیومواد هوشمند را به دلیل توانایی آنها در پاسخ به تغییرات پارامترهای فیزیولوژیکی یا محرک های خارجی [ 83 ، 84 ، 85 ] به خود اختصاص داده اند. این بیومواد قادرند خواص فیزیکی و مکانیکی خود را در واکنش به سیگنالهای بیولوژیکی، شیمیایی و فیزیکی، یعنی دما، رطوبت، pH، پتانسیل ردوکس، فعالیت آنزیمی، نور و محرکهای مکانیکی تغییر دهند. در میان این بیومواد، هیدروژلهای هوشمند اغلب برای مهندسی بافت و کاربردهای دارورسانی مورد استفاده قرار میگیرند [ 86 ، 87 ، 88 ]. در واقع، ساختار هیدروژل را میتوان با استفاده از روشهای برگشتپذیر، مانند اتصال متقابل فیزیکی، درهمتنیدگی ناشی از حرارت و خودآرایی، که ممکن است امکان کنترل آزادسازی دارو و نرخ تجزیه زیستی را فراهم کند، به صورت متقابل پیوند داده شود [ 89 ، 90 ]. هیدروژل های زیست تخریب پذیر اغلب با استفاده از پیوندهای متقاطع قابل جداسازی به دست می آیند که می توانند از طریق هیدرولیز، پروتئولیز یا گسستگی به دنبال یک محرک خاص حل شوند [ 91 ].
علاوه بر این، در این چارچوب، مفهوم جدیدی به نام چاپ زیستی چهار بعدی (4 بعدی) با در نظر گرفتن زمان به عنوان بعد چهارم معرفی شد [ 92 ، 93 ، 94 ]. این تکنیک مبتنی بر این اصل است که بافتهای چاپشده زیستی سهبعدی نیاز به بازسازی در داخل بدن دارند: با استفاده از یک بیوئینک مبتنی بر هیدروژل هوشمند مملو از سلولها، میتوان توانایی بافت مهندسی شده برای رشد و جایگزینی بافت آسیبدیده را با استفاده از محرکهای خاص تحریک کرد.
سایر مواد زیستی مانند آلیاژها و پلیمرهای Shape Memory (SM) دارای توانایی منحصر به فرد برای بازیابی به هندسه و ساختار اصلی خود پس از قرار گرفتن در معرض یک محرک خارجی مانند دما، میدان مغناطیسی، میدان الکتریکی، نور یا رطوبت نسبی هستند [ 95 ]. اثر SM و خواص مکانیکی فوق الاستیک این مواد به طور گسترده در توسعه دستگاههای کاشتنی با حداقل تهاجم و ابزارهای جراحی استفاده شده است. علاوه بر این، رفتار SM اخیراً برای اعطای خواص خود ترمیمی به دستگاههای پزشکی مورد سوء استفاده قرار گرفت و از آسیبهای ناگهانی با بازیابی سریع ساختار و شکل اصلی جلوگیری کرد [ 96 ].
پلیمرهای الکترواکتیو (EAPs) دسته دیگری از مواد هوشمند نوظهور هستند که به عنوان محرک هایی برای توسعه عضلات مصنوعی توجه را به خود جلب کرده اند [ 97 ، 98 ]. این پلیمرها شباهت هایی با پاسخ عملکردی عضلات بیولوژیکی از نظر انعطاف پذیری، مقاومت و کشش یا خمش با تحریک زیاد دارند. بر اساس مکانیسم فعالسازی، EAPها را میتوان به دو دسته تقسیم کرد: EAPهای الکترونیکی که عموما خشک هستند و توسط نیروهای کولن هدایت میشوند و EAPهای یونی که معمولاً حاوی الکترولیت هستند و شامل انتقال یونها یا مولکولها در پاسخ به یک جریان الکتریکی خارجی میشوند. زمینه با این حال، به دلیل نیاز به ولتاژهای محرک بالا و پایداری ضعیف آنها در محیط مرطوب، این پلیمرهای هوشمند عمدتاً در دستگاه های بیومیمتیک، روباتیک و الکترونیک پوشیدنی کاربرد پیدا کرده اند.
نانومواد و بیومواد نانوساختار [ 99 ] همچنین در رباتیک با الهام از زیست برای شبیهسازی ویژگیهای محرک و حسی خاص، مانند، به عنوان مثال، ویژگیهای لمسی پوست انسان یا توانایی برخی از حیوانات برای احساس ارتعاشات ظریف در محیط، مورد استفاده قرار گرفتهاند.
4.4. مواد زیستی که با وزیکول ها عمل می کنند
یکی از جدیدترین کاربردهای بیومواد در پزشکی احیا کننده با استفاده از آنها به عنوان سیستم هایی برای آزادسازی وزیکول های خارج سلولی (EVs) و عوامل محلول نشان داده شده است [ 100 ]. سلولهای بنیادی مزانشیمی (MSCs) سلولهای پیشساز پرتوانی هستند که قادر به تجدید خود، تمایز به دودمانهای متعدد و همچنین انجام اثرات تغذیهای هستند [ 101 ]. این اثرات به دلیل ترشح EV ها است که انواع مولکول های درون سلولی (به عنوان مثال، لیپیدها، پروتئین ها، RNA و DNA) را که برای هدایت فرآیند بازسازی در طول ترمیم بافت مناسب هستند، منتقل می کند. این مولکول ها عملکردهای مختلف سلولی (مانند مهاجرت، تکثیر، تمایز، و سنتز اجزای ماتریکس خارج سلولی) را کنترل می کنند. علاوه بر این، آنها سیستم ایمنی موضعی را سرکوب می کنند، فیبروز و آپوپتوز را مهار می کنند، رگ زایی را تقویت می کنند و میتوز و تمایز سلول های ترمیمی را تحریک می کنند. اثرات درمانی EV های مشتق شده از MSC در بسیاری از مطالعات پیش بالینی مشاهده شد: برای بیماری های مغزی، بیماری های ریوی، آسیب قلبی، آسیب کبدی، آسیب کلیوی و ضایعات پوستی [ 100 ].
بیومواد برای ایجاد پلتفرم هایی برای تحویل درجا خودروهای برقی استفاده می شود، آنها را به یک ماتریس متصل می کنند (یا درون آن جاسازی می کنند تا دسترسی زیستی آنها افزایش یابد. در کار منتشر شده توسط وانگ و همکارانش [ 102 ]، یک هیدروژل مبتنی بر پلی پپتید تزریقی، خود ترمیم شونده و ضد باکتری با اگزوزوم های MSCs مشتق از چربی غنی شد تا بهبود زخم مزمن و بازسازی کامل پوست را بهبود بخشد. این سیستم برای زخم های دیابتی با ضخامت کامل با نتایج امیدوارکننده اعمال شد. در مقاله اخیر مردپور و همکاران. [ 103 ]، اثر درمانی EV ها از سلول های بنیادی مزانشیمی برای درمان بیماری های کبدی نشان داده شد. در این مورد، یک هیدروژل زیست تخریب پذیر تشکیل دهنده در محل برای محصور کردن EV ها پس از تزریق داخل صفاقی استفاده شد: این آزادسازی پایدار با دسترسی به گردش خون سیستمیک را فراهم کرد. هیدروژل توسط ماکرومرهای قابل کلیک پلی (اتیلن گلیکول) (PEG) به دست آمد. مثال دیگری با ادغام اگزوزوم ها در یک هیدروژل مبتنی بر کیتوزان برای درمان ایسکمی اندام عقبی در یک مدل حیوانی ارائه شده است [ 104 ]. مستقل از کاربرد خاص، بیومواد برای هدف قرار دادن EV های مشتق از سلول به صورت محلی و ارائه آنها در مقادیر موثر درمانی ضروری هستند.
5. بیومواد و دستگاه های زیست پزشکی
آیا نیاز بالینی که باعث ایجاد بیومواد جدید می شود، یا در دسترس بودن بیومواد جدید که امکان توسعه دستگاه های نوآورانه را برای رویارویی با نیاز بالینی مناسب می کند؟ این سوال شبیه سوال قبلی است: اول تخم مرغ یا مرغ؟ شاید موضوع پیش پا افتاده و بی معنی باشد. در واقع، ما معتقدیم که تکامل بسیاری از کاربردهای عملی در کلینیک ها همراه با کشف مواد زیستی برای استفاده به تنهایی یا به عنوان بخشی از دستگاه های زیست پزشکی است. گاهی اوقات ترجمه مواد از قبل موجود به عمل بالینی اجازه مدیریت یک نیاز خاص را می دهد. گاهی اوقات یک نیاز خاص هدایت کننده توسعه یک ماده جدید است. دو نمونه از دستگاه های مصنوعی در اینجا ارائه و مورد بحث قرار می گیرد.
5.1. پروتز کامل هیپ
مفصل ران مفصلی است که از اتصال بدن به استخوان ران و لگن حمایت می کند. سر صاف و کروی استخوان ران کاملاً در محل استابولوم قرار دارد. ثبات مفصل توسط رباط های بسیار مقاوم تضمین می شود. لگن باید وزن بدن و فشارهای مکانیکی ناشی از حرکات را تحمل کند: شرایط بارگذاری بیش از حد، آسیب شناسی و پیری می تواند منجر به تغییر در عملکرد مفصل همراه با درد شود [ 105 ]. استئوآرتریت یک آسیب شناسی دژنراتیو است که اغلب مجبور به جایگزینی مفصل آسیب دیده با یک وسیله مصنوعی می شود. این برای انجام همان عملکردهای مفصل طبیعی طراحی شده است. معمولاً از سه جزء اصلی تشکیل شده است: یک ساقه (که در استخوان ران وارد می شود)، یک توپ (سر استخوان ران که به بالای ساقه متصل است) و یک فنجان (که در لگن قرار می گیرد). این عمل جراحی به عنوان آرتروپلاستی کامل هیپ (THA) نامیده می شود.
پس از طراحی دستگاه پروتز برای شبیه سازی سینماتیک مفصل، انتخاب ماده(های) مورد استفاده، موضوع بسیار مهمی است. انتخاب باید با آگاهی از اینکه چندین محدودیت باید مطابقت داشته باشند هدایت شود: زیست سازگاری، مقاومت در برابر خستگی، سختی، چقرمگی، توانایی مقاومت در برابر بارهای استاتیکی و دینامیکی، و مقاومت بالا در برابر سایش مکانیکی و شیمیایی [ 106 ]. معمولاً از مواد مختلفی برای تولید اجزای پروتز استفاده می شود، به طور خلاصه: CoCrMo، Ti6Al4V، آلومینا و زیرکونیا برای ساقه فمور. CoCrMo، UHMWPE، آلومینا برای فنجان. بنابراین، یاتاقانهای مختلف در حال حاضر برای یافتن ترکیب ایدهآلی که کمترین عوارض و بهترین بقای طولانیمدت را به همراه دارد، مورد بهرهبرداری قرار میگیرند : فلز روی پلی اتیلن (M-on-PE)، فلز روی فلز (M-on-). M)، سرامیک روی سرامیک (C-on-C).
بنابراین، چرا یکی از اولین تلاش های ثبت شده (از دکتر کارنوچان به عنوان اولین جراح نام برده می شود که یک وسیله مصنوعی (یک قطعه چوبی!) را بین مفصل ران قرار داد [JV Bono، JC McCarthy، TS Thornhill، BE Bierbaum، و RH Turner, Eds, Revision Total Hip Arthroplasty, Springer-Verlag:New York, 1999]) برای جایگزینی مفصل ران با استفاده از توپ عاج و سوکت ثابت شده به استخوان توسط پیچ انجام می شود [ 107 ، 108 ]؟ صرفاً در آن زمان (سال 1891) عاج موجود بود و از نظر مقاومت مکانیکی و سازگاری ماده خوبی به شمار می رفت. علاوه بر این، با سطح صاف برای حرکات مشخص می شد. سپس سایر مواد موجود مورد بهره برداری قرار گرفتند: لاستیک، شیشه، باکلیت. تنها در اواسط دهه 1900 بود که از فلزات برای ساخت اولین نسل یاتاقان فلز روی فلز استفاده شد [ 109 ]. این زمانی اتفاق افتاد که فناوری پردازش فلز به آن اجازه داد. ابتدا فولاد استفاده شد، سپس آلیاژهای کروم-کبالت-مولیبدن و تیتانیوم جایگزین شدند. با این وجود، خرابی یاتاقان های فلز روی فلز کشف شد و به دلیل "اصطکاک زیاد" به دلیل فرآیند تولید ناکافی نسبت داده شد.
توسعه مواد برای پروتز هیپ هنوز در حال پیشرفت است تا صرفاً از مواد موجود استفاده نشود، بلکه بهطور خاص طراحی شود. در حال حاضر، سرامیک ها به طور گسترده ای مورد استفاده قرار می گیرند زیرا بهترین ویژگی های تریبولوژیکی را تضمین می کنند، اما مواد دیگر در دست بررسی هستند. در این مورد، شایان ذکر است که علاوه بر هر نیاز دیگری، مواد برای تولید پروتز هیپ باید اثر موسوم به "محافظت از استرس" را که در طول سالها بیشتر و بیشتر مورد توجه قرار گرفته است را به حداقل برسانند [ 110 ]. زمانی اتفاق میافتد که یک دستگاه فلزی در تماس عمیق با استخوان باشد: سفتی بالاتر دستگاه باعث از دست دادن استخوان (آتروفی) در نتیجه کاهش شرایط بارگیری میشود یا در جایی که بار افزایش مییابد، استخوان متراکمتری تولید میکند. به عبارت دیگر، وجود دستگاه فرآیند بازسازی فیزیولوژیکی بافت استخوانی را که به درستی تحریک نمی شود، تغییر می دهد. محافظت از استرس می تواند منجر به تحلیل استخوان اطراف پروتز و در نهایت منجر به شکست پروتز مفصل شود: این منجر به نیاز به جراحی تجدید نظر می شود که با افزایش خطرات، عوارض و هزینه ها همراه است [ 110 ].
دو رویکرد برای محدود کردن اثر محافظ تنش پیشنهاد شد: (1) بررسی هندسه و شکل دستگاه، با توجه خاص به ویژگیهای سطح. (ii) انتخاب مناسب ماده انتخابی بسته به سفتی آن. شبیه سازی های عددی [ 111 ] و مطالعات تجربی [ 112 ] هر دو برای بهینه سازی پیکربندی و ترکیب پروتز هیپ اساسی هستند. به طور خاص، بهره برداری از مواد پلیمری کامپوزیت یک استراتژی امیدوارکننده برای طراحی پروتزهای لگن با سفتی قابل تنظیم به نظر می رسد.
اولین مثال توسط کامپوزیت های کربن/PEEK (PEEK مخفف پلی اتر اترکتون) ارائه شده است که عملکرد مکانیکی آنها با فولاد ضد زنگ و تیتانیوم مقایسه شده است [ 113 ]: توزیع تنش با شبیه سازی های عددی برای بررسی مناسب بودن کامپوزیت ها مورد بررسی قرار گرفت. جایگزینی برای فلزات مثال دیگر کامپوزیت پلی آمید 12 فیبر کربن (CF/PA12) است: ظرفیت آن برای ارائه توزیع چگالی یکنواخت در سرتاسر استخوان، که منجر به کاهش اثر محافظ تنش می شود با شبیه سازی های عددی با آلیاژهای CoCrMo و Ti مقایسه شد [ 114 ].
چند ملاحظه الزاماً باید مورد توجه قرار گیرد: اول، پیشرفتهای اخیر در طراحی پروتز کامل هیپ، انتخاب مواد کاندید را از مواد موجود در حال حاضر به موادی که باید بهطور خاص برای این کاربرد تولید شوند، منتقل میکند. دوم، مواد کامپوزیتی، به عنوان موادی که با قرار دادن الیاف سرامیکی/پلیمری در یک زمینه پلیمری به دست میآیند، در مقایسه با مواد سنتی، عملکرد بهتری را تضمین میکنند.
5.2. قلب مصنوعی کامل (TAH)
نارسایی قلبی (HF) یک وضعیت بالینی پیچیده است که به شدت عملکرد قلب را مختل می کند. تا به حال، پیوند قلب تنها راه حل قطعی برای HF مرحله نهایی مقاوم به درمان است [ 115 ]. در واقع، پیوند قلب به دلیل دسترسی کوتاه به اندام از اهداکنندگان، که زمان لیست انتظار را افزایش میدهد، و اثرات نامطلوب ناشی از سرکوب سیستم ایمنی محدود میشود (سرکوب سیستم ایمنی برای اینکه گیرنده بتواند عضو بیولوژیکی اهداکننده را بدون رد میزبانی کند، اجباری است). اینها دلایل اصلی جستجو برای راه حل جایگزین هستند: جایگزینی قلب خراب با پمپ های مکانیکی. پمپها میتوانند «به سادگی» به یک بطن کمک کنند (دستگاه کمک بطنی، VAD) یا جایگزین کل قلب شوند (قلب مصنوعی کل، TAH): هر دو کیفیت زندگی رضایتبخشی به بیماران میدهند و میزان بقا را افزایش میدهند.
همانطور که به وضوح توسط Gino Gerosa و همکاران بیان شده است. "جایگزینی کامل قلب نارسا با یک پمپ مکانیکی برای چندین دهه جام مقدس برای جراحان قلب بوده است" [ 116 ]. در واقع، تحقیقات بسیار مقدماتی با هدف حمایت/جایگزینی قلب بیولوژیکی با یک دستگاه ساخت بشر به اوایل دهه 1800 (بیش از 150 سال قبل از اولین پیوند قلب انجام شده توسط دکتر بارنارد در سال 1967) برمی گردد، زمانی که ایده کمک به یک قلب نارسا با پرفیوژن خارج از بدن تصور شد [ 117 ]. در اواخر دهه 1920، جراح معروف الکسیس کارل، در شراکتی بعید با هوانورد چارلز لیندبرگ، تلاش کرد یک قلب مکانیکی ایجاد کند: این هدف محقق نشد، اما آنها یک اکسیژن ساز پمپ برای پرفیوژن موقت بافت ها و اندام ها ایجاد کردند [ 118 ] . در سال 1957، ویلم کولف و تتسوزو آکوتسو اولین کاشت موفقیت آمیز TAH را در سگی انجام دادند که گردش خون آن به مدت 90 دقیقه ادامه داشت [ 119 ]. قلب «از پلی وینیل کلراید ساخته شده بود. متعاقبا از پلی اورتان استفاده کردیم. و سپس سالیان دراز، سیلاستیک» [ 120 ]. Silastic یک علامت تجاری است که در سال 1948 توسط Dow Corning Corporation برای الاستومر سیلیکونی انعطاف پذیر و خنثی به ثبت رسیده است.
پس از توالی آزمایشات در مدل های پیش بالینی، اولین کاشت TAH در انسان در سال 1969 توسط Denton Cooley و Domingo Liotta [ 121 ] انجام شد. در طول سالها، نمونههای اولیه بسیاری دیگر توسعه یافتند [ 122 ]، اما تاکنون، تنها دو دستگاه وارد عمل بالینی شدهاند: CardioWest TAH (SynCardia، Tucson، AZ، ایالات متحده آمریکا) و Aeson CARMAT TAH (Vélizy-Villacoublay، فرانسه). ) که اخیراً نشان CE و تأییدیه FDA را برای شروع ثبت نام در ایالات متحده دریافت کرده است [ 123 ].
پس از یک کارآزمایی بالینی که در سال 1993 آغاز شد و در سال 2002 به پایان رسید [ 124 ]، CardioWest TAH (با الهام از Jarvik 7 قبلی که در دهه 1980 توسعه یافت و اکنون با نام Syncardia TAH به بازار عرضه می شود) موفقیت بالینی بزرگی را تجربه کرد: تا به امروز، بیش از 1700 بیمار این دستگاه را دریافت کرد. با پلی یورتان پوشانده شده است و دارای دیافراگم های چهار لایه با هدایت پنوماتیک (پلی اورتان) برای جداسازی خون و هوای فشرده در هر محفظه بطنی است [ 124 ]. چهار دریچه مکانیکی (دیسک کج شدن تک برگچه) جریان خون را تنظیم می کند.
مواد پلیمری، نه وابسته به ترکیب شیمیایی خاص خود، و دریچه های مکانیکی سطح خاصی از ترومبوژنیسیته را نشان می دهند. به طور خاص، پلیمرها میتوانند ویژگیهای امیدوارکنندهای را با توجه به فرآیند تولید و عملکرد مکانیکی تضمین کنند، اما نمیتوانند سازگاری با همخوانی مورد نیاز را تضمین کنند. این امر تجویز درمان ضد انعقاد مادام العمر را برای جلوگیری از عوارض ترومبوآمبولیک تحمیل می کند. متأسفانه، ضد انعقاد نامتعادل می تواند منجر به خونریزی و خونریزی شود [ 115 ].
بنابراین، آیا می توان زیست سازگاری دستگاه را با انتخاب (یا توسعه) یک ماده سازگارتر برای پوشش سطوح در تماس با خون بهبود بخشید؟ CARMAT TAH دو نوآوری عمده را با توجه به TAH های موجود ارائه می دهد: (1) دریچه ها مکانیکی نیستند بلکه بیولوژیکی هستند و (2) غشاهایی که محفظه خون را از مایع محرک جدا می کنند از یک ماده بیوپروتز ساخته شده اند [ 125 ]. این دومی با جفت شدن یک پلی اورتان (در سطح تماس با مایع) با پریکارد گاوی تحت درمان شیمیایی (در سمت تماس با خون) به دست می آید. مزیت مورد نظر آن بهبود سازگاری با خون است که به طور بالقوه نیاز به ضد انعقاد طولانی مدت و خطر خونریزی/ترومبوز را کاهش می دهد [ 126 ]. بنابراین، یک ماده زیستی جدید، نه تنها پلیمری و نه تنها بیولوژیکی، بلکه "هیبرید" ایجاد شد. این ایده جذاب است و می تواند راه را برای توسعه سایر دستگاه های تماس خون باز کند، اما آیا واقعاً کار می کند؟ به طور خاص، «بافت پریکارد گاوی تحت درمان شیمیایی» به چه معناست؟
پریکاردی گاو و خوک برای ساخت دریچه های بیوپروستتیک قلب استفاده شده است، اما باید به درستی درمان شوند تا از هرگونه واکنش نامطلوب در هنگام کاشت در انسان جلوگیری شود. بنابراین، پریکارد حیوانی معمولاً با گلوتارآلدئید تثبیت میشود: این یک عامل تثبیتکننده ارزان و مؤثر است، اما همچنین تأیید میشود که منجر به اثرات سیتوتوکسیک میشود و بافت بیولوژیکی را مستعد کلسیفیکاسیون میکند [ 127 ]. برای جلوگیری از (یا حداقل محدود کردن) دژنراسیون کلسیفیک، تغییراتی در بافت پردازش شده با گلوتارآلدئید و فرآیندهای غیر گلوتارآلدئیدی پیشنهاد شد. ما در مورد اثربخشی این روشها بحث نمیکنیم، فقط به این نکته اشاره میکنیم که هر روشی که برای جلوگیری از کلسیفیکاسیون استفاده میشود، بافتهای تحت درمان دیگر حیاتی نیستند: به این معنی است که آنها قادر به ادغام با میزبان نیستند و دوام آنها محدود است. به عبارت دیگر، آنها طبیعت بیولوژیکی دارند، اما پس از کاشت همچنان "جسم خارجی" باقی می مانند.
با بهره گیری از پیشرفت های صورت گرفته در زمینه مهندسی بافت، اخیراً رویکرد متفاوتی برای تولید مواد هیبریدی توسط گروه ما ارائه شده است. ما با حذف سلولها و اجزای هستهای از ماتریکس [ 128 ]، یک درمان سلولزدایی را برای بافتهای بیولوژیکی بومی اعمال کردیم: داربستهای بیولوژیکی با سازگاری ایمنی بهبود یافته و خواص بیولوژیکی و بیومکانیکی بیتغییر با توجه به بافتهای بومی به دست آمد. آنها هنوز حیاتی هستند به این معنا که می توان آنها را با سلول های در گردش پس از کاشت مجدداً جمع کرد [ 129 ]: یک لایه اندوتلیال در داخل بدن روی قسمت تماس با خون غشای هیبریدی که با جفت کردن پریکارد سلول زدایی شده با یک ماده مصنوعی تولید می شود، ایجاد می شود. پلیمر، به عنوان مثال، یورتان پلی کربنات تجاری [ 130 ]. سازگاری هموسازگاری این مواد نوآورانه با ارزیابی ظرفیت آنها برای ترویج تولید ترومبین و القای فعال شدن پلاکت مورد بررسی قرار گرفت. نتایج اولیه ما نشان داد که غشاهای هیبریدی پیشنهادی با خون سازگار هستند [ 131 ].
6. بیومواد از سال 2021 به بعد برای چه منظوری در نظر گرفته شده است؟
در سال 2019، پروفسور بادی راتنر، یکی از برجسته ترین دانشمندان در زمینه علم بیومواد، مروری روشنگرانه در مورد آینده زیست مواد نوشت. او اظهار داشت، و ما با او موافقیم، که حوزه بیومواد با چند رشتهای بودن مشخص بود (و هنوز هم هست). او نوشت: «حوزه بیومواد با پزشکان شروع شد، سپس مهندسان را پذیرفت و با انقلاب زیستشناسی مولکولی انرژی و مشروعیت یافت» [ 132 ]. پروفسور راتنر اصطلاح «همگرایی» را از شارپ و لانگر [ 133 ] به عاریت گرفت تا نشان دهد نوعی «انقلاب» در علم زیست پزشکی با هدف ادغام مهارت های مختلف با نقشی برابر: نیازهای بالینی آینده با همکاری مشترک مهندسان مواجه خواهد شد. ، دانشمندان علوم فیزیکی، زیست شناسان و پزشکان. شارپ و لانگر نمونههایی از این همکاری انقلابی را ارائه کردند: مهندسی بافت معمولاً مبتنی بر بهرهبرداری از زیستشناسی رشد با روشهای مهندسی و مواد برای جایگزینی بافتها و اندامها است. تکنیکهای میکروساخت امکان آنالیز سلولهای منفرد، توسعه نانوذرات درمانی هدفمند را فراهم میکنند. الگوریتم های داده کاوی پزشکی شخصی سازی شده را بهبود می بخشد. میکروسنسورها می توانند شروع بیماری را تشخیص دهند [ 133 ]. اجازه دهید نقش عظیمی را که هوش مصنوعی در طول مسیر مراقبت ایفا می کند، اضافه کنیم [ 134 ].
ما معتقدیم که بررسی حاضر رشد باورنکردنی حوزه بیومواد را از نظر علایق تحقیقاتی و در نتیجه انتشارات علمی نشان داد: اما آیا این یک موفقیت واقعی است؟ پروفسور راتنر در مورد آن شک کرد و استدلال کرد که پیشرفت های ملموس در پزشکی که توسط علم زیست مواد هدایت می شود بسیار کمتر از تعداد مقالات منتشر شده است. او متأسفانه نتیجه گرفت، «این پیشرفتهای جدید، که در هزاران مقاله توصیف شدهاند، تأثیر محدودی بر پزشکی بالینی داشتهاند» [ 132 ]. دلایل اصلی عدم پیشرفت بالینی در تجهیزات پزشکی مبتنی بر مواد زیستی عمدتاً به سه عامل مربوط می شود: سازگاری، دوام و عفونت.
همانطور که قبلاً بحث شد (به پاراگراف 2 مراجعه کنید)، سازگاری به توانایی یک ماده/دستگاه معین برای برانگیختن واکنش های نامطلوب پس از کاشت و اطمینان از عملکرد مورد انتظار دلالت دارد. در مورد خاص مواد/دستگاههای دارای تماس با خون، اصطلاح همسازگاری برای تأکید بر عدم وجود ترومبوژنیسیته و همولیز استفاده میشود. به طور کلی، هیچ ماده/دستگاه قابل کاشتی نمی تواند سازگاری مطلق با میزبان را تضمین کند. در حال حاضر، تمام مواد/دستگاه هایی که برای کاشت در نظر گرفته شده اند، "جسم خارجی" هستند، بنابراین مسئول واکنشی هستند که به ناچار پس از جراحی ایجاد می شود. این واکنش به دلیل التهابی است که از نظر فیزیولوژیکی توسط فرآیند بهبود ایجاد می شود. به عنوان یک رویداد فیزیولوژیکی، نمی توان از التهاب اجتناب کرد: در واقع، حفظ التهاب به عنوان حاد و نه مزمن، برای دستیابی به اصطلاح "restitutio ad integrum" (این اصطلاح لاتین برای نشان دادن ترمیم موفقیت آمیز بافت / اندام استفاده می شود بسیار مهم است. عملکرد پس از تکمیل فرآیند بهبودی) بافت / اندام درگیر.
در مورد مواد و وسایلی که در تماس دائمی با خون هستند، عدم سازگاری کامل با هموسازگاری میتواند برای بیماران بسیار خطرناک باشد: برای جلوگیری از عوارض ترومبوآمبولی، آنها باید با درمان ضد انعقاد تجویز شوند. در واقع، ضد انعقاد اگر به درستی مدیریت نشود، می تواند عوارض جانبی مضری داشته باشد.
همانطور که تمام محصولات ساخت بشر، مواد زیستی فعلی و دستگاه های زیست پزشکی دوام محدودی دارند، که اغلب بسیار کمتر از امید به زندگی بیماران است: برای مثال، میانگین دوام یک پروتز کامل هیپ 15 سال است. انتظار می رود یک دریچه مکانیکی قلب پس از 30 سال جایگزین شود، در حالی که یک دریچه مصنوعی پس از 12 سال.
پیشرفتهای اساسی برای افزایش سازگاری و دوام مواد/دستگاهها زمانی حاصل میشود که تغییر از دیدگاه «جایگزینی» به سمت «بازسازی» با موفقیت تکمیل شود. در واقع، بافتها و اندامهای مهندسی شده زیستی ماهیتی اتولوگ دارند، بنابراین کاملاً سازگار هستند. علاوه بر این، آنها به طور کامل با بدن گیرنده ادغام می شوند، بنابراین فرآیندهای بازسازی را دنبال می کنند تا عملکرد بهتر و دوام بیشتری را تضمین کنند.
منبع: mdpi
